《European Polymer Journal》丨壳聚糖热敏凝胶材料领域的最新研究成果
2023年12月8日,中国医科大学附属盛京医院孙广炜、刘洋研究员团队在《European Polymer Journal》期刊上发表了题为“Chitosan with enhanced deprotonation for accelerated thermosensitive gelation with β-glycerophosphate”的论文,该研究通过添加过量的壳聚糖使得壳聚糖溶液去质子化程度增加提高了溶液pH,并加速了壳聚糖溶液与β-甘油磷酸酯钠(β-GT)的热敏凝胶化过程,获得了一种优化后的壳聚糖(CS)/β-GT凝胶溶液(HpHCS),能够更快地实现注射式壳聚糖的原位凝胶化。长光辰英核心产品——P300激光共聚焦拉曼光谱仪有幸为本研究中新型壳聚糖凝胶的分子结构差异检测提供了有力工具。

一、研究背景
壳聚糖(CS)是一种天然多糖,由甲壳素N-去乙酰化而得。它是唯一带正电的线性聚合物,由氨基葡萄糖和N-乙酰氨基葡萄糖单位组成。它还具有抑菌、止血、抗癌、增强免疫力、促进伤口愈合等作用,并因此被广泛应用于食品、医药、保健、化妆品等领域。CS不溶于水,但可溶于无机酸和有机酸。传统的CS/β-GP凝胶制备方法是由于β-甘油磷酸钠(β-GP)逐渐加入到CS溶液中时,含β-GP的CS/β-GP混合溶液能够在低温下保持液体状态,含有药物或细胞的CS/β-GP混合物可以在此时注射到体内,进入体内后可以在体温下原位形成凝胶。为了在注射后实现药物或细胞的原位快速稳定固定,避免损失,需要增加CS/β-GP混合物的温度敏感性,缩短体温下的凝胶时间。
二、实验方法
本研究通过改进壳聚糖溶液的制备方法致力于解决CS/β-G凝胶溶液在体温下凝胶化时间较长导致药物流失的问题。由于CS在粉末状态时仅溶于酸,因此研究通过在稀酸中加入过量的壳聚糖粉末,由未溶解的CS的氨基质子化消耗了更多的自由氢离子(质子),显著提高了CS溶液的pH值。接着,去除未溶解的CS后,得到了pH值较高(最大接近6.2)的CS溶液(图1)。
该方法增加的CS溶液pH值可以同时提高溶解的CS链上氨基的去质子化程度。接下来,研究对比了使用传统方法和改进方法制备的CS溶液和CS/β-GP凝胶在重要物理性质(产率、粘度、分子结构、实际CS浓度和pH值)方面的差异。
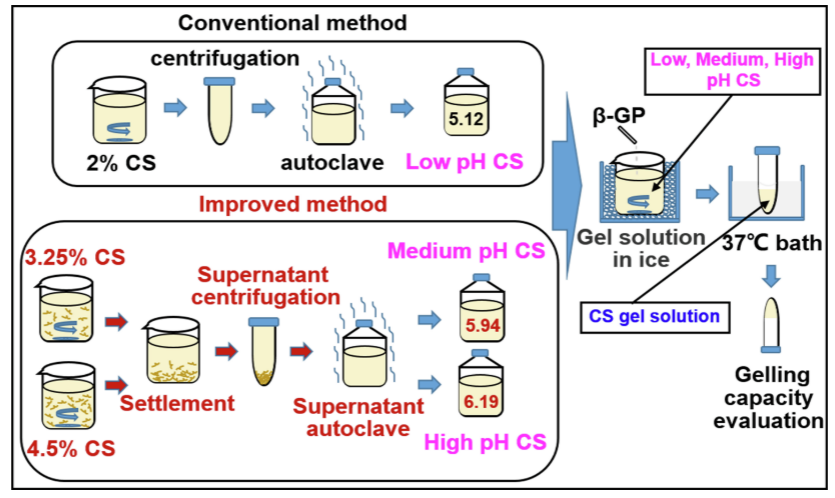
三、结果
1.新型CS的制备
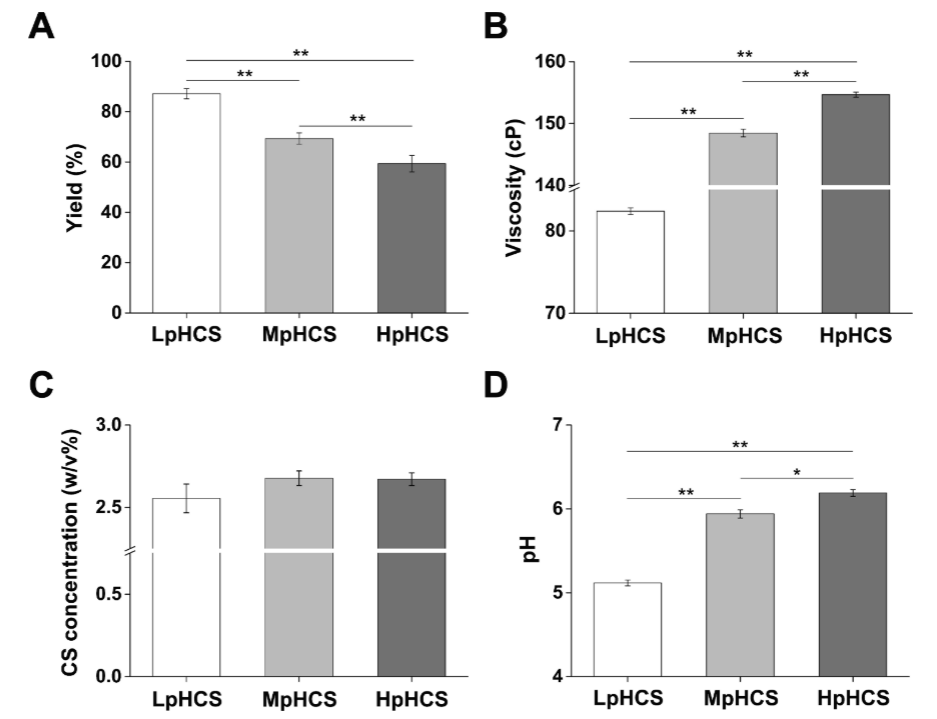
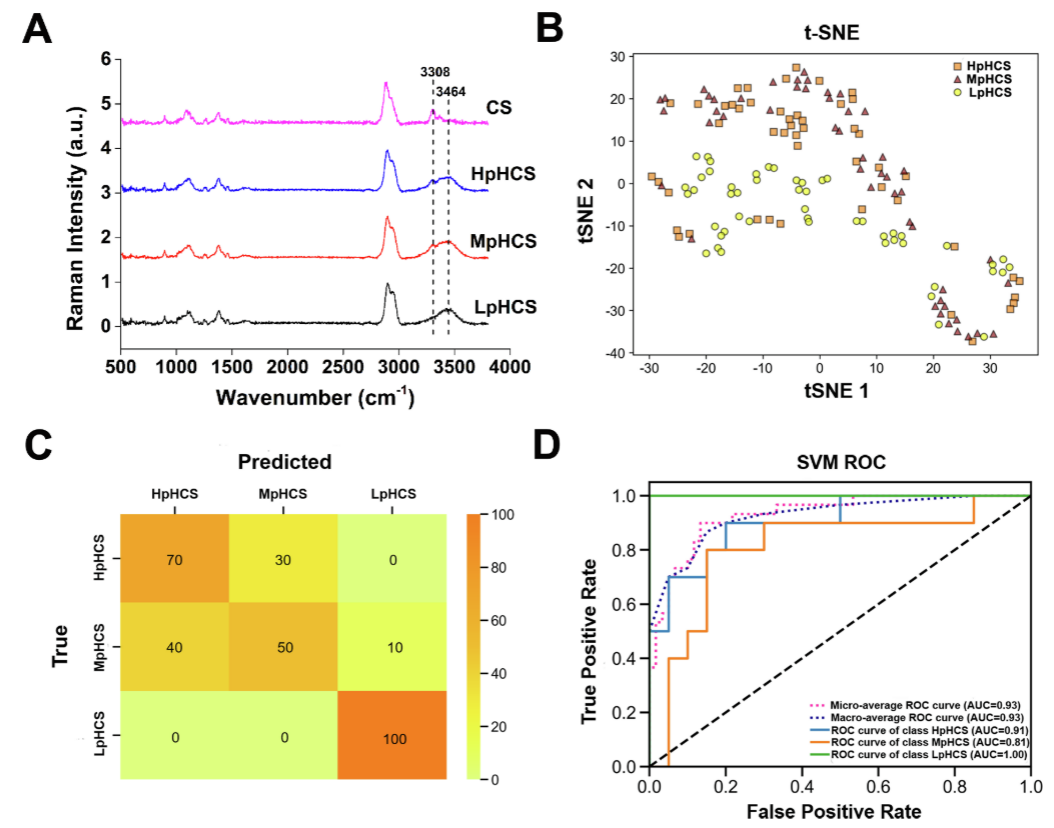
大量CS粉末加入后,pH的持续升高可能加速了溶解的CS氨基的去质子化,从而增强了氢键,为验证该推测,研究采用HOOKE P300 pro激光共聚焦拉曼光谱仪对CS粉末及不同浓度CS溶液进行了拉曼光谱检测。结果发现,相较于CS粉末而言,CS溶液在3464cm-1处发现了一条新的宽吸收带(图3A),推测该峰可能与CS溶解后游离羟基和分子内外氢键的羟基的伸展ν(OH)模式相对应。
另外,CS的羟基在光谱中对应于3308 cm-1峰位,比较了三种浓度的CS羟基峰的振动强度,结果发现HpHCS的振动强度明显高于LpHCS,略高于MpHCS。
采用HOOKE P300 pro的自带分析软件对三种浓度的CS溶液拉曼光谱进行tSNE降维聚类,结果发现HpHCS和MpHCS相较于LpHCS而言有显著差异(图3B),但该算法条件下无法区分HpHCS和MpHCS。接着,研究对拉曼光谱进行了支持向量机(SVM)的分类,结果发现每个样本的整体准确率在50%-100%之间相对较低(图3C),但LpHCS的分类准确率达到了100%。另外,该预测的ROC曲线的AUC大于0.8,说明该模型预测结果可靠(图3D)。
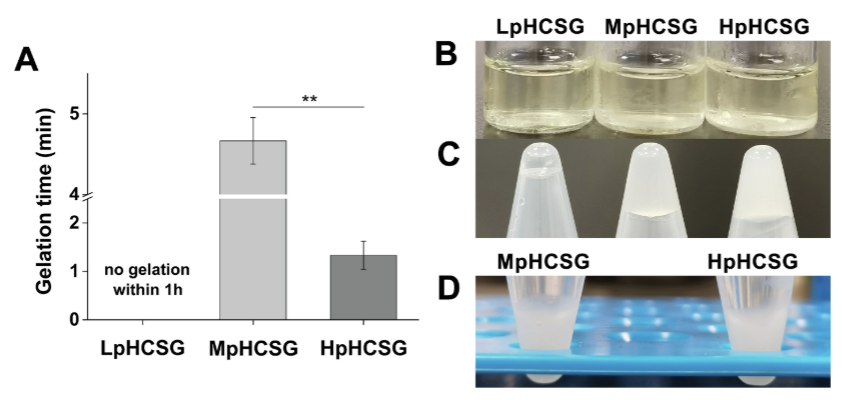
为探究HpHCS高pH对热敏凝胶的影响,研究将等量的β-GP加入了三种不同浓度的CS溶液中。结果发现低温下,三种溶液均呈现透明状(图4B),随温度升高HpHCS的凝胶时间最短(图4AC),并在37℃的PBS中具有良好的稳定性(图4D)。
后续研究对三种溶液的扭矩曲线和吸光度等进行了测定,进一步确定了HpHCS在三组溶液中具有最快的热敏凝胶能力。
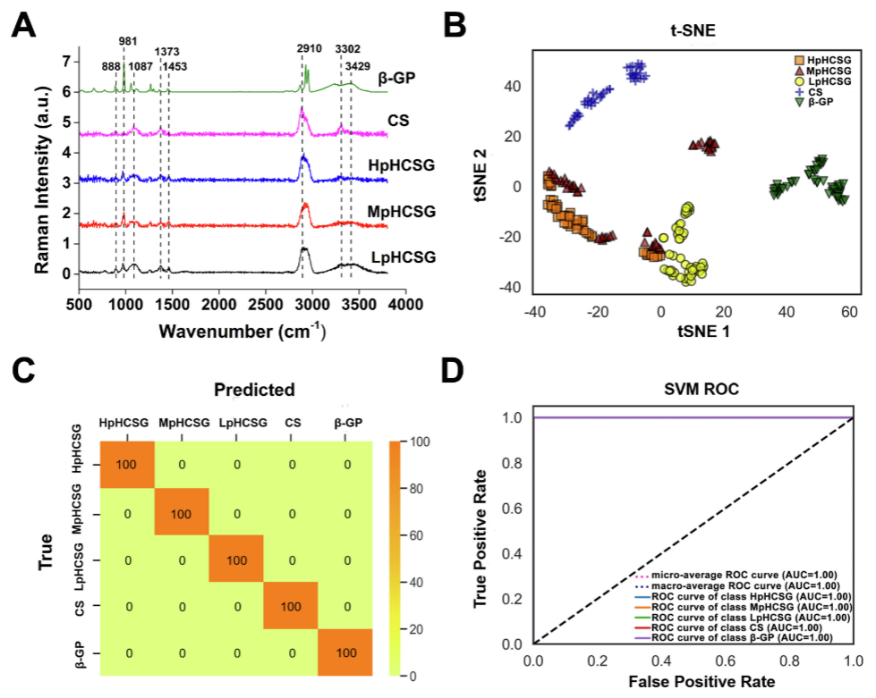
同样的,研究对三种CS/β-GP凝胶也进行了拉曼光谱检测(HOOKE P300 pro),结果发现,三种CS/β-GP凝胶的拉曼光谱与CS粉末的拉曼光谱较为相似(888、1087、1373、1453、2910、3302 cm-1),但凝胶较粉末多了β-GP的特征峰(981、3429 cm-1)。另外,在3000-3700 cm-1范围内,HpHCSG、MpHCSG和LpHCSG凝胶之间的拉曼光谱存在一些差异(图5A),O-H拉伸带在该区域较为突出。因此,推测三种凝胶在该范围内的拉曼光谱差异与氢键有关。
同时,tSNE结果显示,三组CS/β-GP凝胶之间存在显著分离(图5B)。SVM分类模型在预测三组CS/β-GP凝胶时的准确率为100%(图5C),ROC曲线也证实该模型可靠(图5D)。
最后,该研究过程中还对新型CS/ β-GP凝胶的稳定性和细胞毒性,以及β-GP添加剂量对该凝胶的影响进行了探究,最终确定新型CS/ β-GP凝胶HpHCSG的稳定性较好,并未影响细胞增殖。另一方面,研究拟合了CS/ β-GP体积比对凝胶时间的影响方程,并确定CS的最佳终浓度为1.66%。
四、结论
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0014305723004123
五、辰英价值


该研究中采用的激光共聚焦拉曼光谱仪HOOKE P300 pro,该仪器是长光辰英研制的一款高端科研级激光共聚焦拉曼光谱仪。仪器集高灵敏度、高稳定性为一体,内置独特的多维校正装置,保证样品光谱不受测试环境干扰,满足拉曼数据库构建对光谱稳定性的要求;全自动数据采集,大大提高科研效率;搭载深度学习算法,帮助用户自建专属数据库;HOOKE IntP智能分析软件,可帮助用户深度挖掘图谱内在信息。同时,P300 pro具有强大的扩展功能,可为不同应用场景提供完整的解决方案。


六、研究团队介绍













