《Advanced Science》北京大学王玮、大连医科大学附属第二医院王琪联合李备团队开发全血中富集分选高活性CTC新策略

2025年1月27日,北京大学集成电路学院王玮教授团队与大连医科大学附属第二医院王琪教授团队、中国科学院长春光机所李备研究员团队联合在《Advanced Science》上合作发表了题为“High-Viability Circulating Tumor Cells Sorting From Whole Blood at Single Cell Level Using Laser-Induced Forward Transfer-Assisted Microfiltration”的文章,第一作者为许清梅博士与王云桐博士。文中提出了一种全血中单个循环肿瘤细胞(Circulating tumor cells, CTCs)无标签富集与回收方法,将激光诱导向前转移技术(Laser-induced forward transfer, LIFT)与双层微滤器(Double-stepped microfilter, DSMF)相结合,在单细胞水平上构建了集成CTC富集与分选系统(Laser-induced forward transfer-assisted microfiltration system, LIFT-AMFS)。长光辰英核心产品——PRECI SCS-F荧光单细胞分选仪作为LIFT-AMFS中的单细胞可视化精准分选平台,助力DSMF富集,为CTCs的高活性分选与收集提供了有力工具。


循环肿瘤细胞(CTCs)是肿瘤转移检测和个性化医疗的重要生物标志物。然而,传统的CTC分析方法(如计数或染色)在分子水平上的表征能力有限。单细胞分选技术作为促进个性化肿瘤学发展,探究肿瘤转移机制的新工具,在近年来取得了显著进展,包括荧光激活细胞分选、磁激活细胞分选以及基于微孔或微滴的方法。然而,这些技术不适用于处理稀有细胞或少量细胞样本。因此,开发一种能够从全血中高效分选并获取高活性CTC单细胞的技术平台显得尤为重要。
二、研究方法

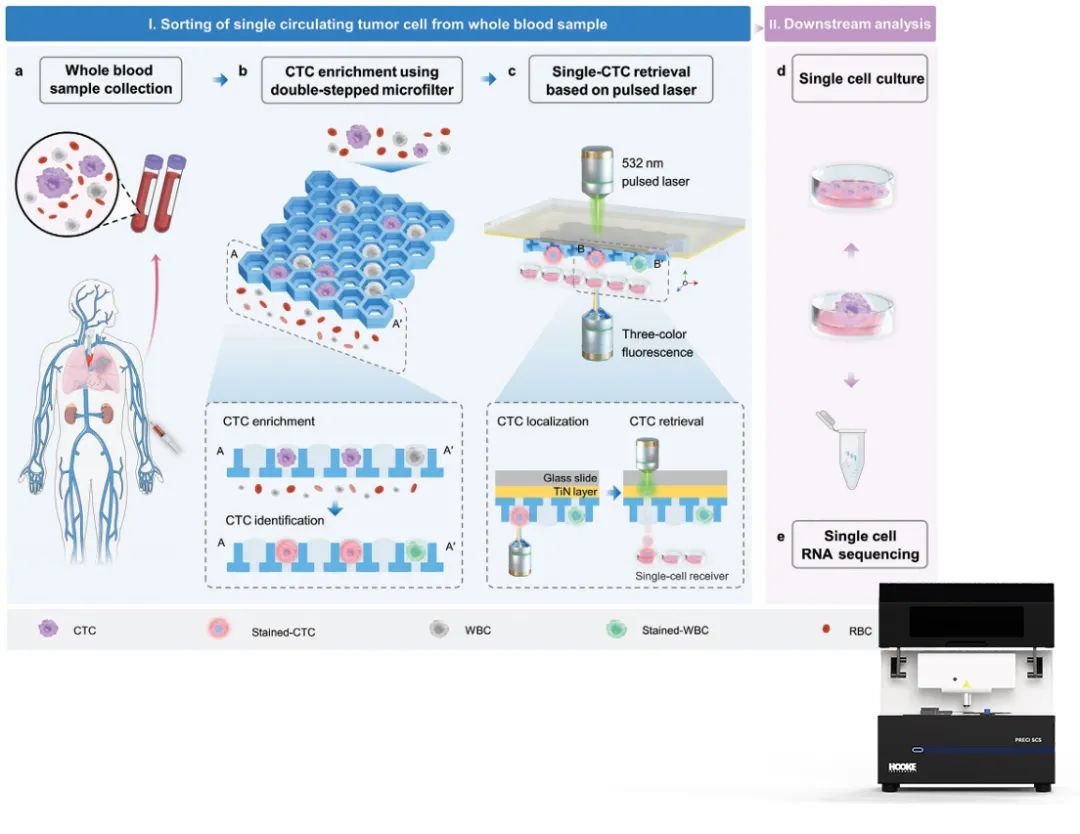
本研究开发了一种激光诱导向前转移-微滤系统(LIFT-AMFS),用于从全血中高效回收高活性的单个CTC。研究主要开发制造了LIFT兼容的双层微滤器(DSMF),它由两层微孔组成:下层较小的微孔用于基于细胞大小的非目标细胞分离,上层较大的微孔则用于捕获单细胞液滴。采用人肺癌细胞添加至PBS或健康人全血中,模拟肿瘤患者全血中的CTCs。通过CTC回收率和活性检测验证了DSMF的富集效果,并结合PRECI SCS-F荧光单细胞分选仪实现全血中高活性CTC单细胞回收,利用单细胞RNA-Seq(Single cell RNA sequencing, scRNA-Seq)和单细胞离体培养验证了LIFT-AMFS的回收单个CTC的活性及有效性,系统工作原理流程如图1所示。
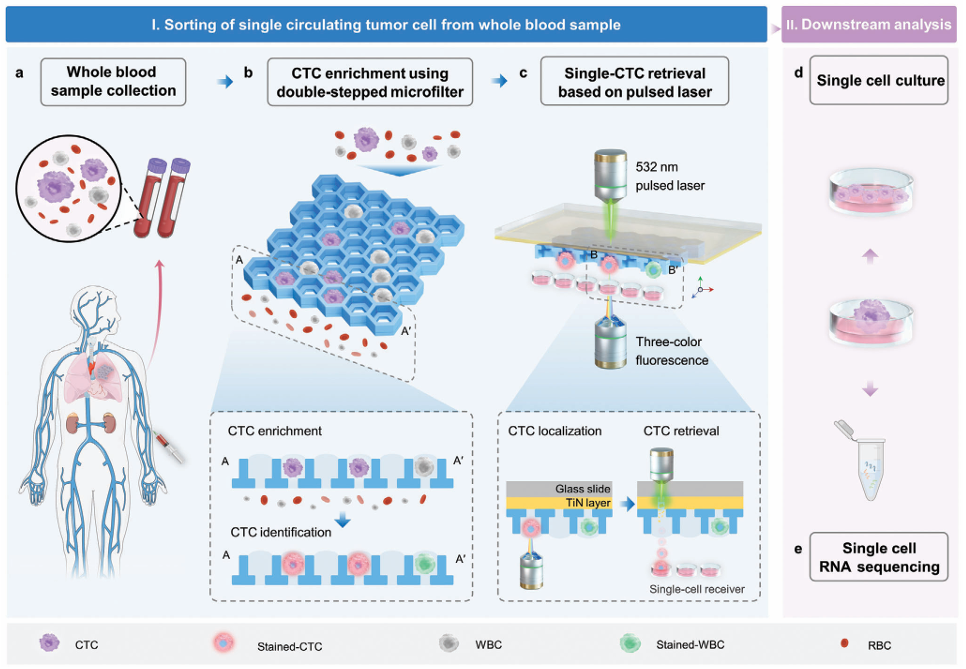
图1 LIFT-AMFS 进行单 CTC 富集和分选的原理概述
图a为稀有肿瘤细胞添加到全血中制备模拟样品流程;图b为使用DSMF富集CTC,并进行染色鉴定CTC的流程;图c为基于LIFT技术定位和回收目标CTC;图d为回收细胞在细胞接收器内体外培养和增殖;图e为回收细胞的RNA提取与处理,以进行单细胞转录组分析

DSMF分为上下两层,滤孔呈密排六边形,上层微孔孔径大于下层微孔孔径,下层微孔基于细胞尺寸分离CTC细胞,实现CTC富集;上层用于封装CTC液体层,减少表面张力的同时,保持细胞活性(图2 a)。
将稀有肿瘤细胞分别添加至PBS与健康人全血中验证DSMF的富集回收率与通量,结果表明,在不同尺寸的DSMF设计中,CTCs在PBS和全血中的捕获效率分别为80.1%~87.4%和76.2%~88.3%(图2 b),处理通量最高可达15.0 mL/min。
对DSMF富集后的细胞活性进行验证,结果表明,DSMF捕获的CTC细胞活性为81.3 ± 6.5%(图2 e)。将DSMF捕获的细胞进行原位培养,随着时间推移,分离细胞表现出良好的粘附和增殖能力(图2 f),进一步证实了DSMF的生物相容性。
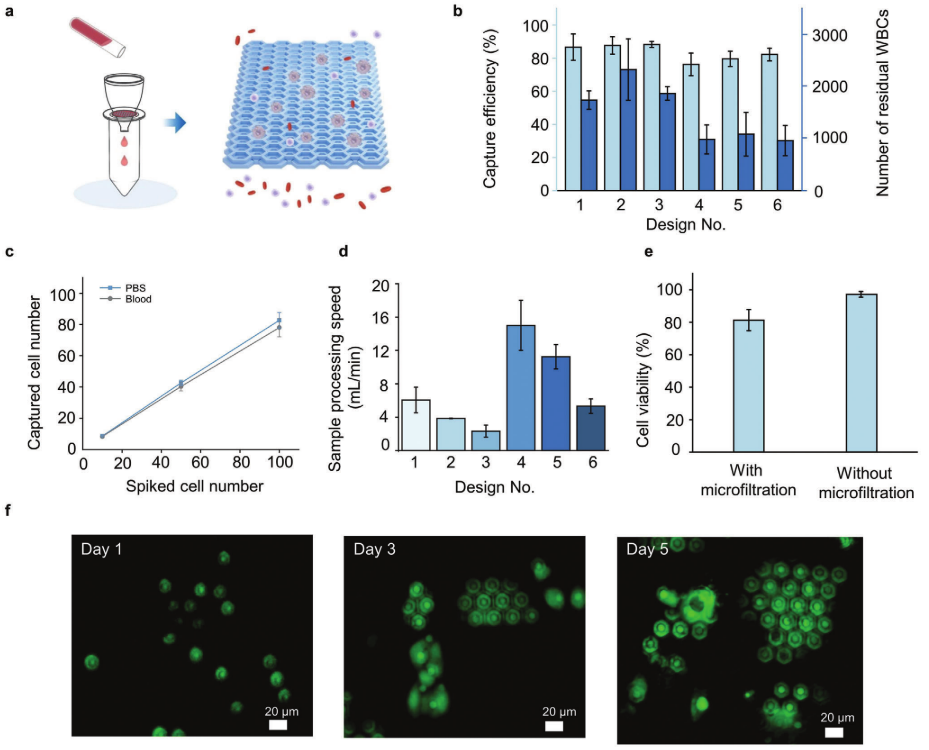
图2 DSMF富集效果验证
图a为DSMF富集CTC原理图;图b为DSMF微滤器在全血样品中捕获肿瘤细胞的效率(浅蓝色条)和白细胞残留数量(深蓝色条);图c为不同细胞浓度下的细胞捕获效率;图d为DSMF的样品处理效率;图e为DSMF富集前后肿瘤细胞的活性;图f为捕获的肿瘤细胞在微滤器上的原位培养显微照片
2. 单个CTC的精准分选回收
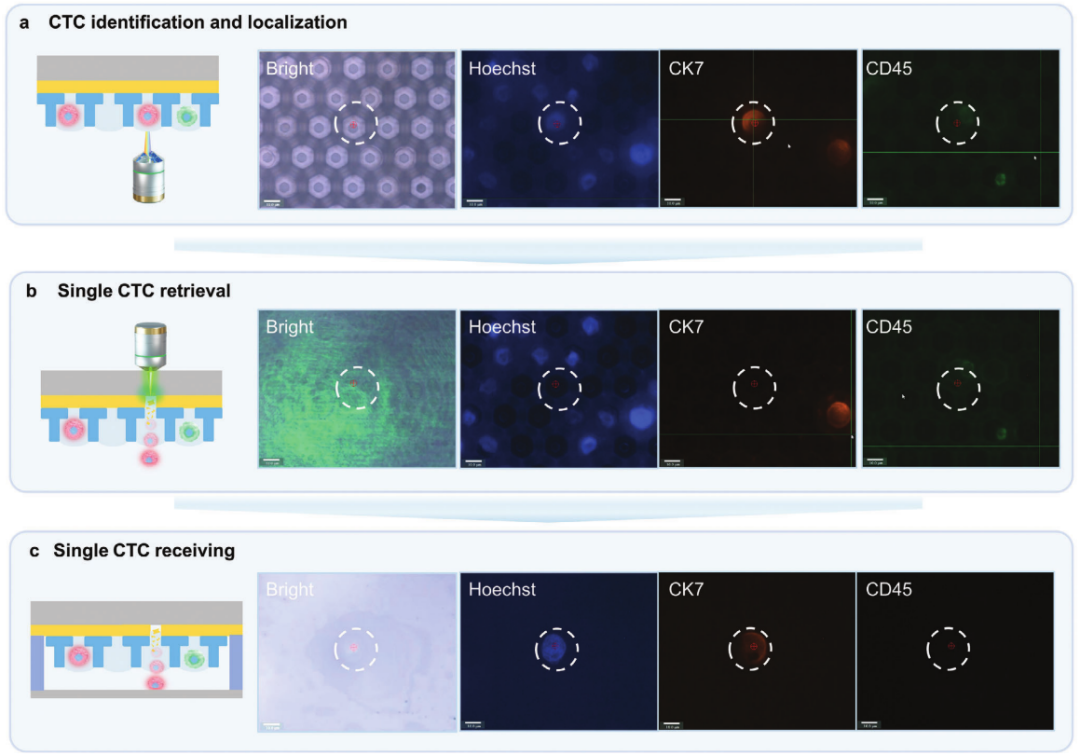
图3 LIFT-AMFS系统单细胞分选流程及荧光显微图像
图a为明场和荧光下微孔中CTC细胞的鉴定和定位;图b为PRECI SCS-F荧光单细胞分选仪的脉冲激光将细胞推出微孔的过程;图c为细胞接收器中成功接收单个CTC的示意图与显微图像
为确定LIFT分选后的CTC活性,并验证LIFT-AMFS系统回收单细胞用于下游分子分析的可行性(图4 a),对分选得到的CTC分别进行了离体培养与scRNA-Seq。结果表明,回收的CTC保持了高活性(图4 b)和基因组完整性。回收CTC的cDNA产量超过4.5 ng(图4 c),scRNA-Seq的Q30得分均高于95.92%,且生物重复之间呈现强相关性(图4 d, e),表明了分选回收细胞的可靠性和一致性。
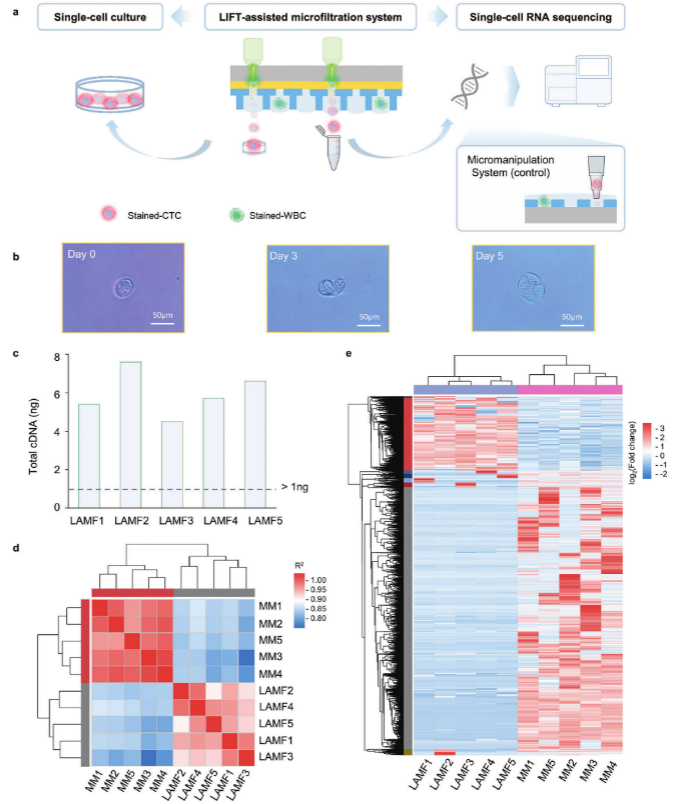
图4 LIFT-AMFS回收细胞活性与下游scRNA-Seq分析结果
图a为通过LIFT-AMFS回收单个CTC后进行单细胞培养和scRNA-Seq的总体工作流程;图b为LIFT-AMFS回收第0天、第3天和第5天的肿瘤细胞的培养增殖结果;图c为分选单个CTC逆转录的cDNA含量;图d为LIFT-AMFS (LAMFX, X = 1,2,3,4,5)和显微操作系统(MMX, X = 1,2,3,4,5)处理的CTC单细胞样品间的scRNA-Seq相关性热图;图e为LIFT-AMFS和显微操作系统scRNA-Seq得到的差异基因聚类表达热图

本研究成功开发并验证了LIFT-AMFS系统用于从全血中无标记、快速地富集和精准分选高活性CTC。该系统在CTC富集阶段的捕获效率高达88%,最高处理通量达到15.0 mL/min,分选阶段的单细胞得率超过95%。与现有其他单细胞分选平台相比,LIFT-AMFS系统在无标记富集、细胞活性保持和单细胞分选精度方面表现出显著优势,为肿瘤生物学研究提供了有力的工具。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202414195

本研究中构建了LIFT-AMFS高活性CTC富集分选平台,采用了长光辰英自主研发的PRECI SCS-F荧光单细胞分选仪作为细胞富集后的单细胞分离系统。该仪器不仅可以在显微物镜下直观识别多重荧光染色的CTC,并且能够基于LIFT原理实现单个CTC的精准、无损分离,保障了回收CTC的活力。下游单细胞培养与scRNA-Seq结果均表明PRECI SCS-F具有细胞高活性分选的能力。除本文中的CTC分选外,长光辰英还推出了Honey Array微阵列分选培养芯片,可实现液体中微生物单细胞的高活性分选。
另外,本研究中验证DSMF富集后CTC细胞活性的荧光染色成像采用了长光辰英的S3000超快三维荧光成像系统,该仪器采用LED面光源激发,降低了光毒性,同时,转盘式共聚焦技术极大提高了成像速度,在本文高效验证了DSMF富集后CTC的活性。


北京大学博雅特聘教授,博导,教育部长江学者特聘教授,国家卓青,微米/纳米加工技术国家级创新团队学术带头人。长期从事微系统相关技术研究,主持国家重点研发计划等多项国家级项目,在Lab Chip、IEEE MEMS、ECTC等领域重要期刊和会议上发表学术论文190余篇,授权发明专利40余项(美国专利2项)。担任微米纳米加工技术全国重点实验室主任,中国微米纳米技术学会副秘书长,中国仪器仪表学会微纳器件与系统技术分会、中国机械工程学会微纳制造技术分会、中国微米纳米技术学会微纳流控技术分会和微纳米制造及装备分会等学会理事,国家集成电路标准委员会委员、特种元器件标准委员会委员(微系统专项组组长),《Microfluidics and Nanofluidics》副主编、《Microsystems & Nanoengineering》编辑等社会和学术职务。

王琪,大连医科大学附属第二医院呼吸内科二级教授,医学博士,主任医师,博导,呼吸学科带头人、肺癌中心主任。先后被评为国家卫生健康突出贡献中青年专家、国务院特殊津贴专家、辽宁省先进工作者、辽宁省特聘教授等多项荣誉个人。现任中国医师协会呼吸分会常务委员、中华医学会内科分会委员、中华医学会呼吸分会肺癌学组委员等,并兼任The clinical respiratory journal 副主编、《中华结核与呼吸杂志》和《中国肺癌杂志》编委。主要研究方向为“基于微流控芯片技术的肺癌基础与临床研究”。主持“国家863计划项目”、“国家自然科学基金重大科研仪器项目、重点项目及面上项目”等国家级课题8项;以第一完成人身份获辽宁省科技进步一等奖、教育部科技进步二等奖、华夏医学科技进步二等奖、中华医学会科技进步三等奖等多项奖项;主编及参编著作4部,发表论文100余篇,包括The Lancet Digital Health、Advanced Material、Journal of Thoracic Oncology 等杂志;获国家发明专利6项。

中国科学院长春光机所光学系统先进制造全国重点实验室研究员,工业与信息化部产业发展项目专家,博导,生物光子学科带头人。获得国家海外人才计划,人社部国家高层次留学人才回国资助项目,吉林省长白山特聘领军人才,吉林省拔尖创新人才人员(一层次),吉林省国家级领军人才(B类);2017年底归国后创立长春长光辰英生物科学仪器有限公司(长光辰英),带领科研创新实验室X-Lab,与牛津大学、格拉斯哥大学、卡迪夫大学等国际顶尖光学及微流控等领域科学家合作,专注于细胞操纵、拉曼光谱、共聚焦成像、微流控和人工智能五大核心领域。实验室目前拥有近20位硕博士科研团队,发表SCI论文20余篇,承担国家及省部级研发项目10余项,展现出强大的研发和创新能力。







