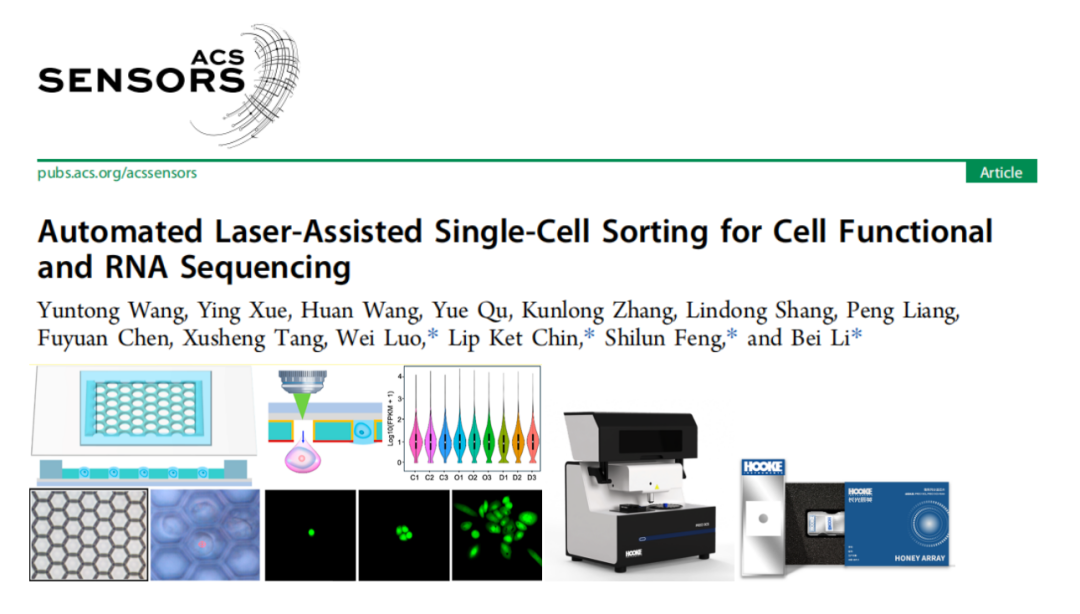
《ACS Sens.》丨“激光诱导+微阵列芯片”高活性单细胞分选新技术的深度解密
2025年1月,中国科学院长春光机所李备研究员团队联合中国科学院上海微系统与信息技术研究所冯世伦教授、香港理工大学Luo Wei 教授、香港城市大学 Lip Ket Chin 教授在《ACS Sensors》(2025, 10, 846−856)合作发表题为《Automated Laser-Assisted Single-Cell Sorting for Cell Functional and RNA Sequencing》的研究论文,王云桐博士为第一作者。该文章详细介绍了基于激光诱导向前转移(LIFT)技术与微阵列芯片的高效自动化单细胞分选技术,该技术具有高细胞活率、高分选精度且能精准识别稀有细胞的特点,为解析细胞异质性、推动精准医疗研究提供了关键工具。其中,长光辰英核心产品PRECI SCS可视化单细胞分选仪结合HoneyArray微阵列芯片构成活体单细胞分选平台,而S3000超快三维荧光成像系统则承担了实验中高效荧光成像工作。
01 研究背景单细胞分析是解析细胞异质性、探索生命活动机制的核心手段,在肿瘤研究、精准医疗等领域至关重要。然而,传统单细胞分选技术存在诸多局限:手动显微操作效率极低,难以满足高通量需求;流式细胞术虽通量高,但机械应力易降低细胞活率;微流控技术则面临易堵塞、下游培养困难等问题。这些挑战导致单细胞分选的效率、精准度与细胞活性难以兼顾,制约了下游转录组测序等分析的可靠性。因此,开发一种兼具高通量、高精准度和高细胞活率的自动化分选技术成为当务之急。
研究背景单细胞分析是解析细胞异质性、探索生命活动机制的核心手段,在肿瘤研究、精准医疗等领域至关重要。然而,传统单细胞分选技术存在诸多局限:手动显微操作效率极低,难以满足高通量需求;流式细胞术虽通量高,但机械应力易降低细胞活率;微流控技术则面临易堵塞、下游培养困难等问题。这些挑战导致单细胞分选的效率、精准度与细胞活性难以兼顾,制约了下游转录组测序等分析的可靠性。因此,开发一种兼具高通量、高精准度和高细胞活率的自动化分选技术成为当务之急。
02 研究方法
研究方法
该研究整合激光诱导正向转移(LIFT)技术与微阵列芯片,构建了自动化单细胞分选系统,核心流程如下:
1)芯片制备:微阵列芯片由金属涂层玻璃基底与微孔膜组成,含超过12万个六边形微孔(直径25 μm),通过等离子体处理调控膜表面亲疏水性,利用表面张力形成单细胞皮升液滴;2)目标识别:基于自研光学显微系统(含荧光成像模块),通过明场或荧光信号识别异质细胞群中的目标细胞;3)激光分选:采用脉冲激光(350 nJ)聚焦于目标细胞所在微孔,通过LIFT机制产生液流,将单细胞转移至96孔板;4)下游验证:对分选细胞进行培养、单细胞RNA测序(scRNA-seq),验证细胞活性与转录组完整性。 图1 自动化激光辅助单细胞分选系统用于单细胞培养和RNA测序的流程概述。
03 结果
结果
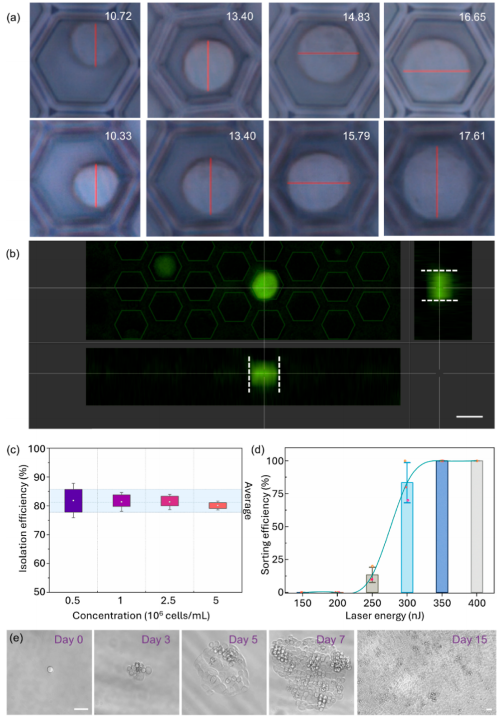
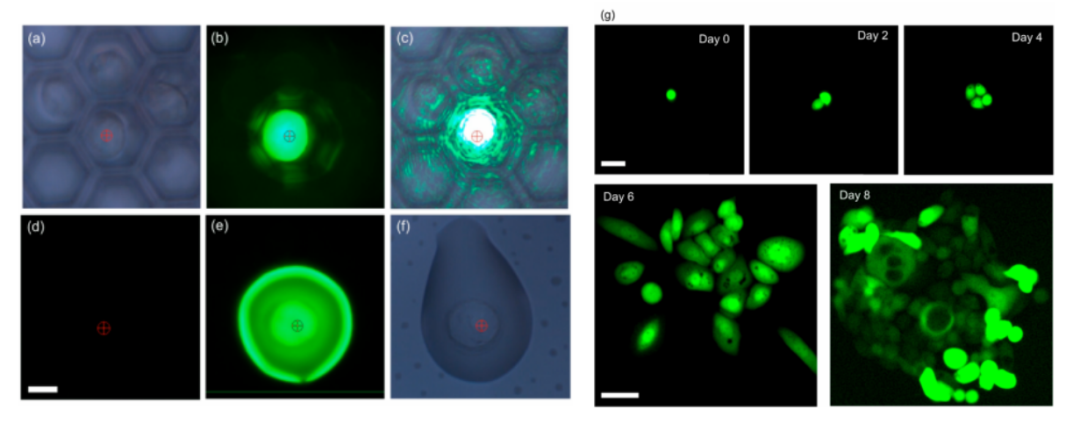
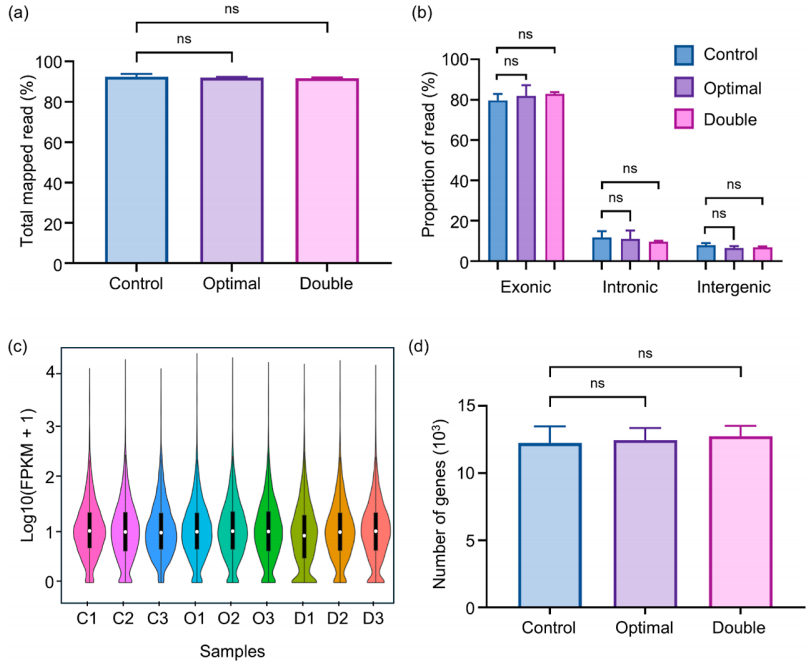
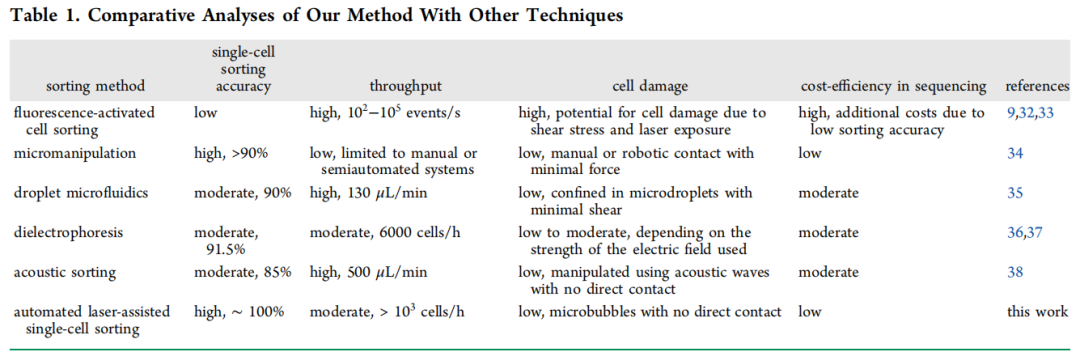
该系统核心为微孔阵列芯片与LIFT技术结合的设计:微孔阵列膜(10 mm×10 mm)包含超过12万个六边形微孔,孔径(25 μm)与单细胞尺寸(10-20 μm)匹配,通过重力(G)、毛细力(Fcf)、附着力(Faf)与表面张力(Fst)的协同作用,使细胞悬液快速形成单细胞皮升液滴。分选时,脉冲激光聚焦于目标细胞所在微孔,通过金属膜瞬时汽化产生空化泡,驱动液滴喷射至96孔板,实现自动化精准分选。(a) 微阵列芯片,包含用于单细胞分离的微孔膜。(b) 制备的微孔膜显微照片。比例尺为 20 μm。(c) 示意图展示细胞液滴沉积到微孔阵列芯片上的初始状态和最终状态,最终实现每个微孔内的单细胞分离。(d) 细胞液滴的受力分析。(e) 基于激光诱导向前转移(LIFT)的目标细胞分选过程中单个目标细胞释放操作的示意图。分离效率:当PC-9(人肺腺癌细胞系)细胞浓度为5×10⁵-5×10⁶cells/mL时,单细胞分离效率稳定在80%以上,共聚焦成像证实细胞被精准限制在微孔内;分选参数优化:激光能量350nJ时,分选效率达100%,细胞存活率79.2%±4.2%,且分选后细胞可连续培养15天;温度安全性:有限元模拟显示,激光作用产生的热量仅在3μm范围内扩散,细胞所在区域温度<37°C,无热损伤风险。(a)单个PC-9细胞在不同微孔中分离的图像,标注了每个细胞的直径。(b)单个PC-9细胞在微孔中被分离的共聚焦图像。(c)不同细胞浓度下的单细胞分离效率。(d)不同激光能量下单个目标细胞的分选效率。(e)激光辅助单细胞分选系统分选后,单个PC-9细胞在不同时间点的培养显微图像。在转染率1%-5%的PC-9细胞群中,该分选系统通过荧光信号识别GFP标记的CLIC4过表达细胞,激光分选后成功培养至第8天,荧光活性保持稳定。整个过程无交叉污染,细胞损失率极低,验证了稀有细胞分选的可靠性。(a)待分选目标细胞的明场图像、(b)荧光图像及(c)激光叠加图像。接收孔的荧光图像(d)分选前和(e)分选后。(f)目标细胞分选后盖玻片的明场图像。(g)荧光显微图像展示通过激光辅助单细胞分选仪分选后,单个目标细胞在不同时间点的生长状态。本研究选择最温和的单细胞分选方法——口吸法作为对照,评估新方法对细胞转录组的影响。结果显示,该技术分选细胞的scRNA-seq数据与对照高度一致:总比对率均超91%,外显子reads占比、基因表达分布及检出基因数无显著差异,即使激光能量提升至800nJ,转录组完整性仍稳定。(a)使用手动显微操作技术(对照组)、激光辅助单细胞分选仪在最佳能量350nJ(最佳组)及更高能量800nJ(双倍能量组)条件下,RNA测序获得的总比对reads数占参考基因组reads数的百分比。(b)根据比对结果计算的比对到外显子区、内含子区和基因间区的reads占比。(c)所有基因表达的分布图。(d)基因数量的分布图。此外,表1系统对比了该技术与FACS、液滴微流控等主流方法,在分选精度、细胞损伤等关键指标上的优势更清晰可见。
04 结论
结论
该研究开发的可视化单细胞分选技术实现了三大突破:①单细胞分离准确率≈100%,兼容5×10⁵-5×10⁶cells/mL 浓度范围;②细胞存活率>80%,满足下游培养需求;③支持高质量 scRNA-seq,且操作简便(一键分选),克服了传统方法的低效率、高损伤等局限。该技术为单细胞多组学分析、稀有细胞(如循环肿瘤细胞)筛选及精准医学研究提供了可靠工具,有望推动单细胞功能与多组学研究。
原文链接:https://doi.org/10.1021/acssensors.4c02417
05 辰英价值
辰英价值
长光辰英的PRECI SCS可视化单细胞分选仪是本研究的核心工具,其整合的纳秒级激光系统与高精度XY位移台,实现了100%的分选精准度与80%的细胞存活率,为自动化分选提供了硬件保障;配套的微阵列芯片通过12万级微孔设计与精准亲疏水调控,支撑了活体单细胞分离效率,满足高通量实验需求。
同时,S3000超快三维荧光成像系统凭借其高分辨、高扫描速度等特点,完成了本研究中细胞定位、转染效率验证及分选后细胞状态监测等细胞成像实验。长光辰英“分选-成像”解决方案,为单细胞研究提供了高效、可靠的实验工具,助力科研人员突破技术瓶颈,探索细胞异质性的奥秘。
 研究背景
研究背景 研究方法
研究方法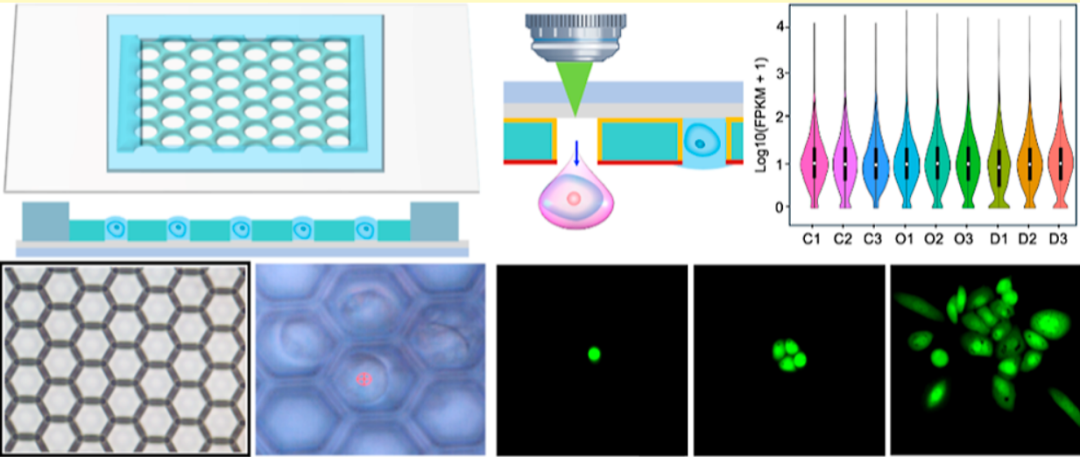
 结果
结果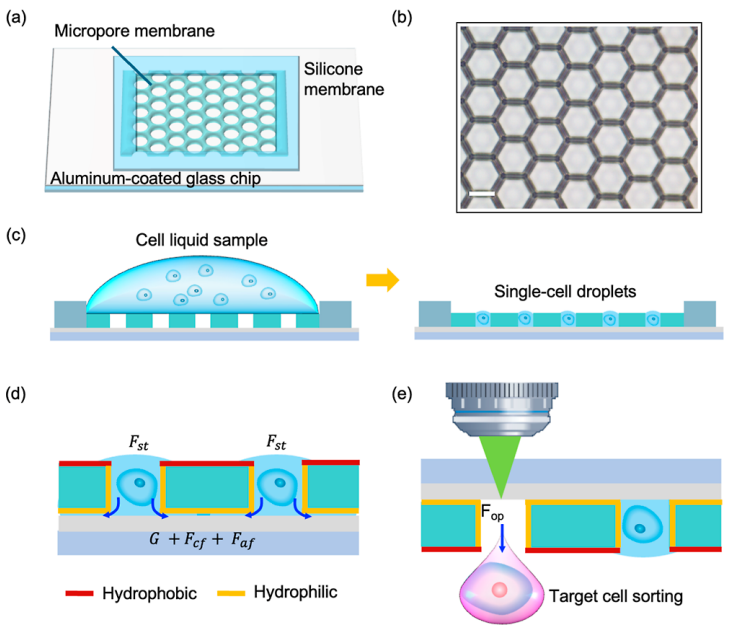
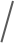 结论
结论 辰英价值
辰英价值


 研究背景
研究背景 研究方法
研究方法
 结果
结果




 结论
结论 辰英价值
辰英价值
