《Analytical Chemistry》丨江南大学研究团队聚焦白酒酿造质控,建立高温大曲微生物代谢活性单细胞拉曼-氘探测评估新方法


传统大曲质量评估依赖“感官经验+理化指标”(如酸度、酶活),缺乏微生物代谢活性评价;高通量测序虽能解析群落结构,却难以关联微生物的实际功能;平板计数、荧光染色等传统活性检测方法又受限于“可培养性差、耗时久、指标不稳定”等问题。因此,开发一种原位、无损、精准的高温大曲微生物代谢活性评估技术,成为突破白酒酿造质量控制瓶颈的关键需求。

(1)样品预处理:大曲参照行业标准测定总酸与酶活等指标,再取1 g大曲样品与PBS缓冲液匀浆,经Nicodenz密度梯度离心(4℃、14000 g、90 min)分离微生物,反复清洗后获得纯净微生物悬液;
(2)氘同位素标记:将微生物悬液与50%(V/V)D₂O共孵育,设置0、6、12、24、48、72 h共6个时间梯度,通过监测C-D键生成评估代谢活性;
(3)单细胞拉曼检测:采用长光辰英P300共聚焦拉曼光谱仪(激发功率3 mW,采集时间5 s)获取单细胞拉曼光谱,对光谱进行去宇宙射线、基线校正与归一化处理,排除低信噪比(SNR)光谱以保证数据质量;
(4)数据分析与模型构建:通过Kruskal-Wallis检验确定最优孵育时间,基于C/D比(C-D峰面积/(C-D+C-H峰面积))分类代谢模式;结合LDA降维、PLS分析筛选特征峰,并通过线性相关、Spearman相关分析建立拉曼表型(C/D比、特征峰强度)与大曲物化性质的关联;最终以ResNet50为框架构建2D-CNN模型,实现大曲微生物代谢活性型的快速判别。
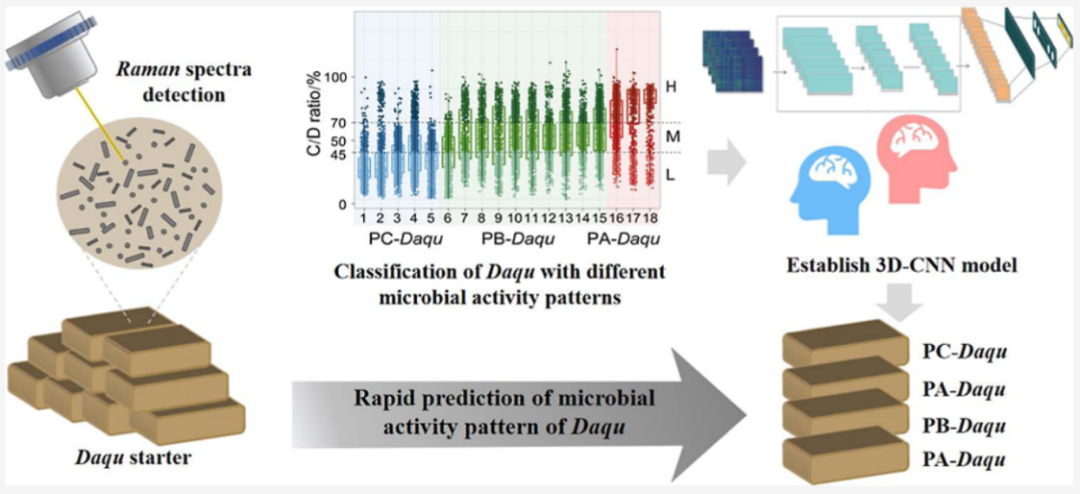
图1:高温大曲微生物代谢活性研究实验流程示意图

3.1 确定最优D₂O孵育时间:48h
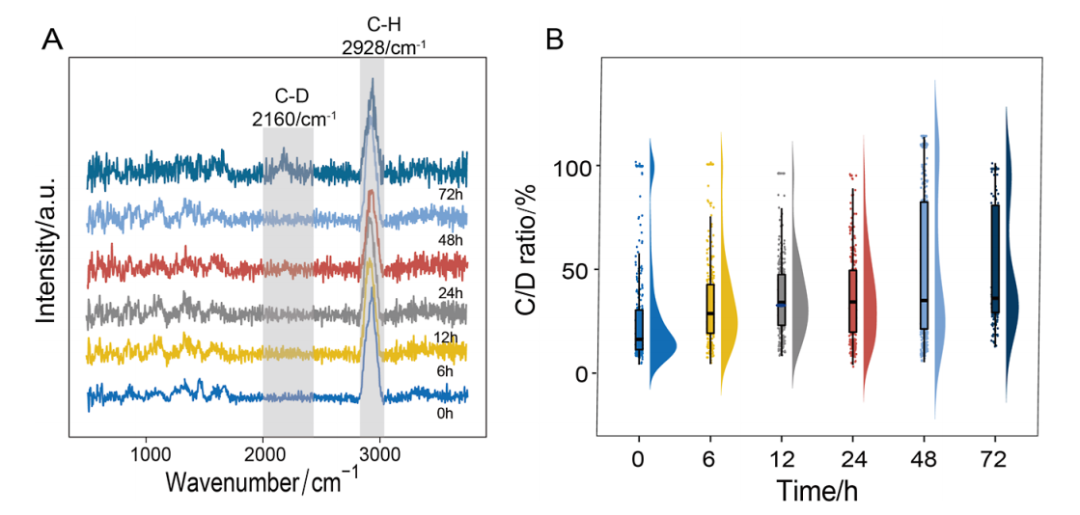
图2:D₂O孵育时间对高温大曲微生物拉曼光谱的影响;
A:不同孵育时间的平均拉曼光谱,灰色阴影标注C-D与C-H区域;B:C/D比随孵育时间的变化趋势
3.2 高温大曲微生物代谢模式分为三类
基于48 h孵育后的单细胞C/D比中位数,18个大曲样品被明确分为三类微生物代谢活性型(图3A):
lPA-Daqu(高活性型):C/D比>70%(median=79.91%),微生物代谢能力最强;
lPB-Daqu(中活性型):C/D比45%-70%(median=58.46%),微生物代谢活性中等;
lPC-Daqu(低活性型):C/D比<45%(median=40.01%),微生物代谢活性最弱;
三类样品的C/D比差异极显著。进一步通过LDA降维分析,发现前两个判别轴可解释57.07%和42.93%的差异,三类微生物代谢活性型大曲在低维空间聚类可明显区分(图 3B);其中低活性微生物(浅色)因光谱特征相似聚集于中心区域,高、中活性微生物则呈分散且独立的聚类分布。这些结果揭示了复杂高温大曲微生物群中,微生物代谢活性存在显著分化且呈现明显的聚类特征,为后续解析代谢活性与大曲功能的关联奠定了基础。
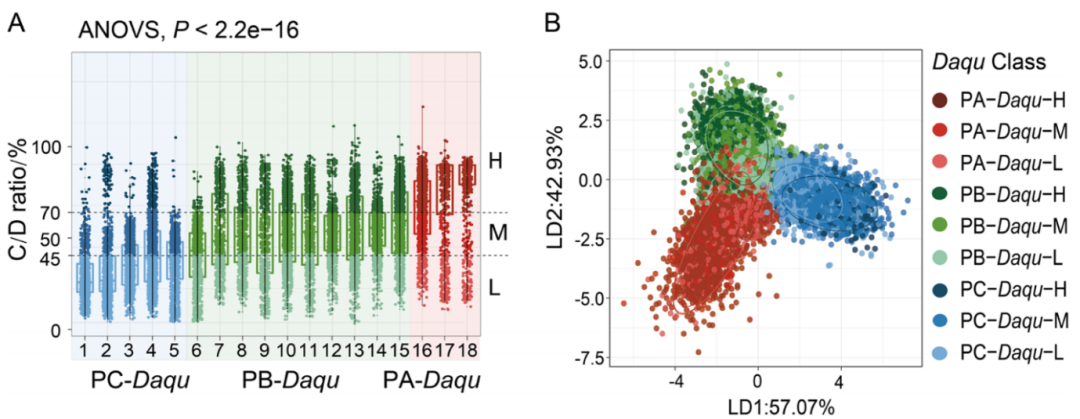
图3:18个高温大曲样品的微生物活性评估;
A:基于C/D比的分类结果,不同颜色代表不同代谢活性;B:单细胞拉曼光谱的LDA分析,不同符号代表不同代谢活性型
3.3 PLS分析识别22个代谢关联拉曼特征峰
通过偏最小二乘(PLS)分析,从拉曼指纹区(500-1800 cm-1)筛选出22个与微生物代谢活性显著相关的特征峰(VIP>1),并明确其化学归属(图4A):
· 蛋白质相关峰:658 cm-1、1248 cm-1(酰胺III)、1594 cm-1(苯丙氨酸C-C)等;
· 脂质相关峰:788 cm-1、1740 cm-1(酯类C=O伸缩)等;
· 核酸相关峰:764 cm-1(嘧啶环)、916 cm-1等;
· 碳水化合物相关峰:542 cm-1(糖苷键COC)、1028 cm-1等。
对比显示:PC-Daqu的蛋白质、脂质、核酸、碳水化合物特征峰强度均显著低于PA-Daqu与PB-Daqu(图4B),其中PA-Daqu的1594 cm-1(蛋白质)、764 cm-1(核酸)峰强度显著高于PB-Daqu,表明这些生化组分的差异是大曲代谢活性分化的关键因素。
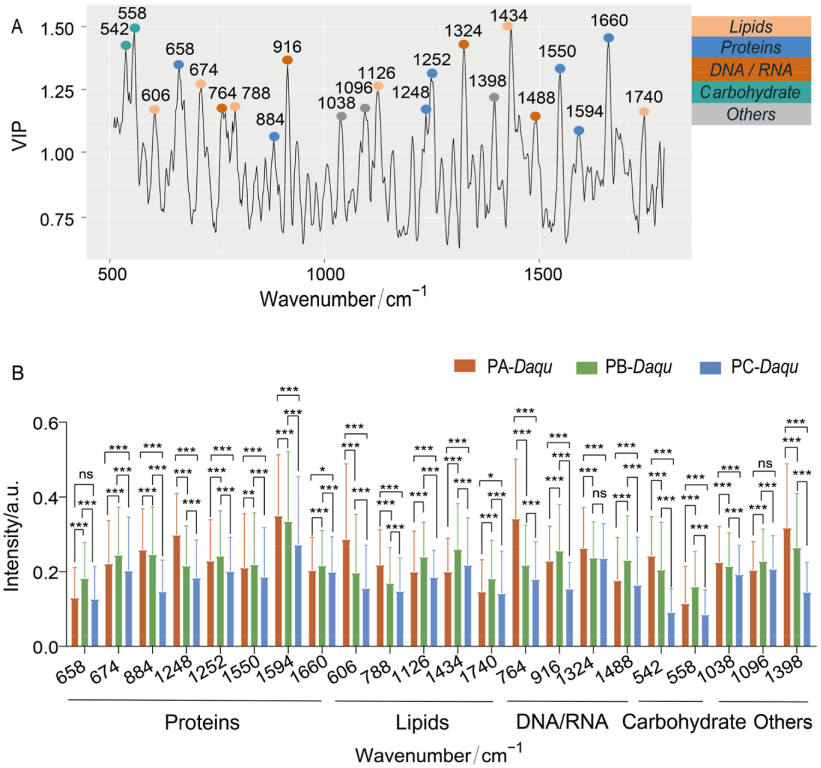
图4:不同微生物代谢活性高温大曲的拉曼特征峰PLS分析结果;
A:采用PLS模型区分不同微生物代谢活性高温大曲微生物拉曼光谱图谱的载荷图,纵轴VIP值表示对应光谱峰对PLS模型的贡献度;B:比较不同微生物代谢活性高温大曲的拉曼峰强度
3.4 拉曼表型与理化性质显著关联
线性回归分析显示,表征微生物代谢活性的C/D比与高温大曲总酸度(R²=0.42,P=0.004)、液化酶活性(R²=0.25,P=0.036)、糖化酶活性(R²=0.33,P=0.013)均呈显著相关性(图5A),提示微生物代谢活性与大曲核心理化功能直接相关;Spearman相关性分析进一步显示,拉曼特征峰强度与多项理化指标显著相关(P<0.05,图 5B),其中542 cm-1(碳水化合物相关峰)、884 cm-1(蛋白质相关峰)强度与总酸度、中性蛋白酶活性、纤维素酶活性呈正相关,1740 cm-1(酯类C=O伸缩峰)可反映有机酸浓度变化,1650-1680 cm-1(酰胺I 带)与蛋白质合成(酶活前体生成)密切相关。
上述分析成功建立体外理化表型与拉曼表型的对应关系,在高温大曲发酵的低pH环境下,拉曼光谱可实现大曲微生物表型活性及代谢动态的实时、无损分析,为快速解析微生物的功能适应提供有效技术途径。
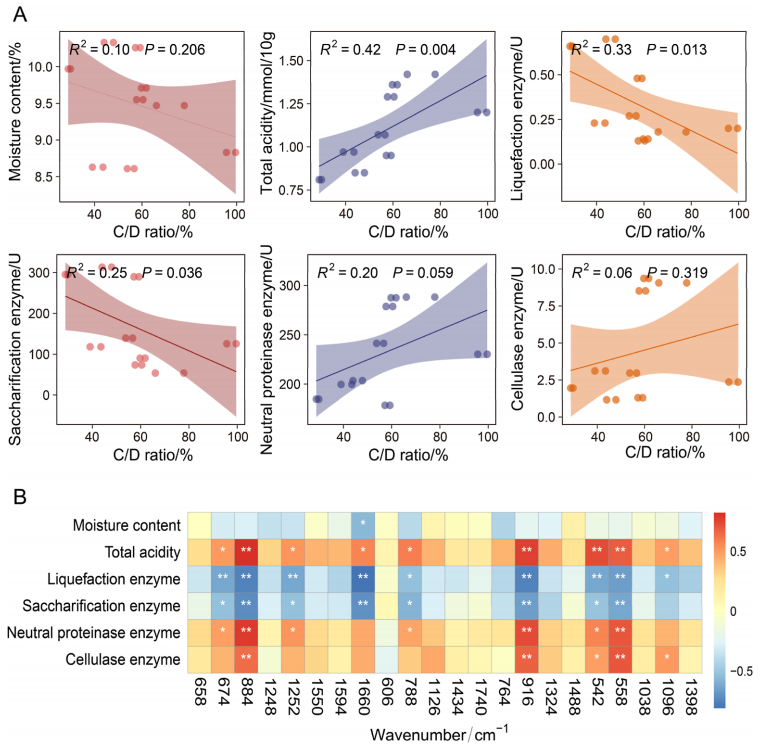
图5:高温大曲微生物代谢活性与理化性质的相关性分析;
(A)高温大曲不同微生物代谢活性下,理化指标与C/D比值间的线性回归分析;(B)微生物理化指标与特征峰强度的Spearman相关性分析
3.5 2D-CNN模型实现99%准确率的代谢模式判别
基于22个拉曼特征峰构建ResNet50-2D-CNN模型,以150个拉曼矩阵(每个矩阵含300个单细胞光谱)为训练集(70%)、测试集(20%)、验证集(10%)。模型训练结果显示:迭代100次后,训练集与验证集的损失值降至0,准确率达 99%(图6A);混淆矩阵表明,模型对PA、PB、PC三类大曲的预测类别与实际类别完全匹配(图6B),可实现未知大曲样品代谢模式的快速、精准判别。
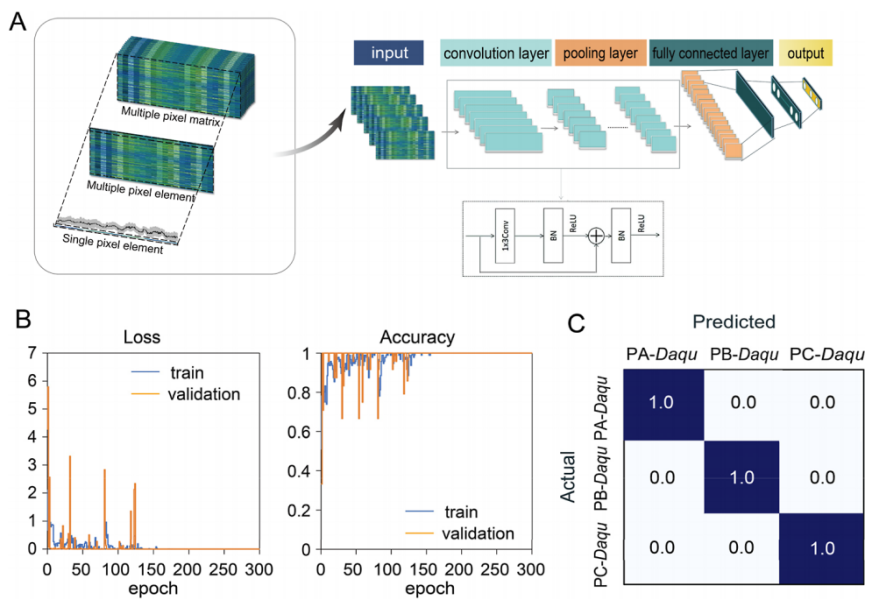
图 6:用于识别具有不同微生物代谢活性的高温大曲微生物单细胞拉曼光谱的二维卷积神经网络(2D-CNN)分类模型构建;
(A)高温大曲微生物代谢活性分类的2D-CNN工作流程;(B)2D-CNN模型在100轮训练中的损失值与准确率变化;(C)验证集的混淆矩阵,用于展示2D-CNN模型的分类性能

(1)确定48 h为大曲D₂O孵育的最优时间,可通过C/D比准确量化微生物代谢活性;
(2)将18个高温大曲样品分为高(PA)、中(PB)、低(PC)三类代谢活性型,三类样品的C/D比与拉曼特征峰强度差异显著;
(3)筛选出22个与代谢活性相关的拉曼特征峰,涵盖蛋白质、脂质、核酸、碳水化合物等关键生化组分,揭示了代谢活性型分化的分子基础;
(4)建立了拉曼表型与理化表型的关联(C/D比、特征峰强度与总酸度、液化酶/糖化酶活性显著相关);
(5)构建的2D-CNN模型以99%准确率实现代谢模式判别,为高温大曲质量快速分级与白酒酿造过程控制提供了全新技术方案。
原文链接:
https://doi.org/10.1021/acs.analchem.5c03199

凭借硬件稳定性与软件智能化的协同优势,P300不仅助力科研工作者开展高通量、无损的微生物功能解析,也为白酒酿造等产业质量控制提供了前所未有的工具支持。



陆震鸣教授
江南大学生物工程学院教授、博士生导师,现任粮食发酵与食品生物制造国家工程研究中心副主任。主要从事酿造微生物生态学研究。受聘为中国调味品协会科学技术委员会委员、团体标准工作委员会副主任委员,中国食品工业协会全国调味品专家委员会委员,国家固态酿造工程技术研究中心工程技术委员会委员,四川省固态酿造技术创新中心专家委员会委员,酿酒生物技术及应用四川省重点实验室学术委员会委员;《中国调味品》杂志青年编委。获“全国科技系统抗击新冠肺炎疫情先进个人”称号。

许正宏教授
四川大学轻工科学与工程学院教授、博士生导师,四川大学先进酿造科技创新中心主任。主要从事工业微生物资源开发及应用研究。受聘为国家固态酿造工程技术研究中心副主任、中国微生物学会酿造分会理事、分子微生物学专业委员会委员,中国调味品协会感官评价专业委员会主任委员、科学技术委员会副主任委员、标准化委员会副主任委员等;担任《Food Microbiology》、《Systems Microbiology and Biomanufacturing》等期刊编委。

李备研究员
中国科学院长春光机所光学系统先进制造全国重点实验室研究员,工业与信息化部产业发展项目专家,博导,生物光子学科带头人。获得国家海外人才计划,人社部国家高层次留学人才回国资助项目,吉林省长白山特聘领军人才,吉林省拔尖创新人才人员(一层次),吉林省国家级领军人才(B类);2017年底归国后创立长春长光辰英生物科学仪器有限公司(长光辰英),带领科研创新实验室X-Lab,与牛津大学、格拉斯哥大学、卡迪夫大学等国际顶尖光学及微流控等领域科学家合作,专注于细胞操纵、拉曼光谱、共聚焦成像、微流控和人工智能五大核心领域。实验室目前拥有近20位硕博士科研团队,发表SCI论文20余篇,承担国家及省部级研发项目10余项,展现出强大的研发和创新能力。







