用户文章|《Cell Death & Differentiation》化疗可诱发“多发性硬化样”中枢神经损伤,并可被氯倍他索逆转
(IF 15.4|S3000超快三维荧光成像系统支撑神经机制研究)
2025年,四川大学华西医院神经外科刘艳辉教授、杨万纯副研究员与生物治疗研究中心陈米娜副研究员团队在《Cell Death & Differentiation》(影响因子15.4)期刊发表研究论文《Chemotherapy induces multiple sclerosis-like neuropathologies that can be rescued by clobetasol》。该研究系统揭示化疗药物在中枢神经系统中可诱发类似多发性硬化(Multiple Sclerosis,MS)的病理改变,包括脱髓鞘、神经炎症及轴突损伤,并提出氯倍他索(Clobetasol,CBT)作为潜在干预策略,可在成年动物模型中显著逆转上述神经损伤。
该研究在关键组织学与机制验证环节,采用S3000超快三维荧光成像系统完成多靶标免疫荧光成像,为研究结论提供了稳定可靠的技术保障。


01
研究背景
化疗在延长患者生存期方面发挥了重要作用。然而,随着治疗周期延长与随访数据积累,部分接受化疗治疗的患者逐渐出现不同程度的神经系统及精神行为异常,其潜在中枢神经毒性开始受到关注,但相关病理机制仍缺乏系统阐释。
在本研究中,研究团队首先通过临床影像学随访发现,部分胶质瘤患者在放疗联合化疗过程中,侧脑室前角及视神经等区域出现进行性白质异常信号,提示可能存在脱髓鞘或神经炎症相关改变。在进一步结合系统综述与Meta分析结果后,研究团队确认化疗与神经/精神不良事件风险升高之间存在统计学相关性。
基于上述临床线索,研究提出核心科学问题:化疗是否会在中枢神经系统中诱发类似多发性硬化的病理特征?其关键细胞类型与分子机制是什么?是否存在可有效逆转该损伤的药物干预策略?
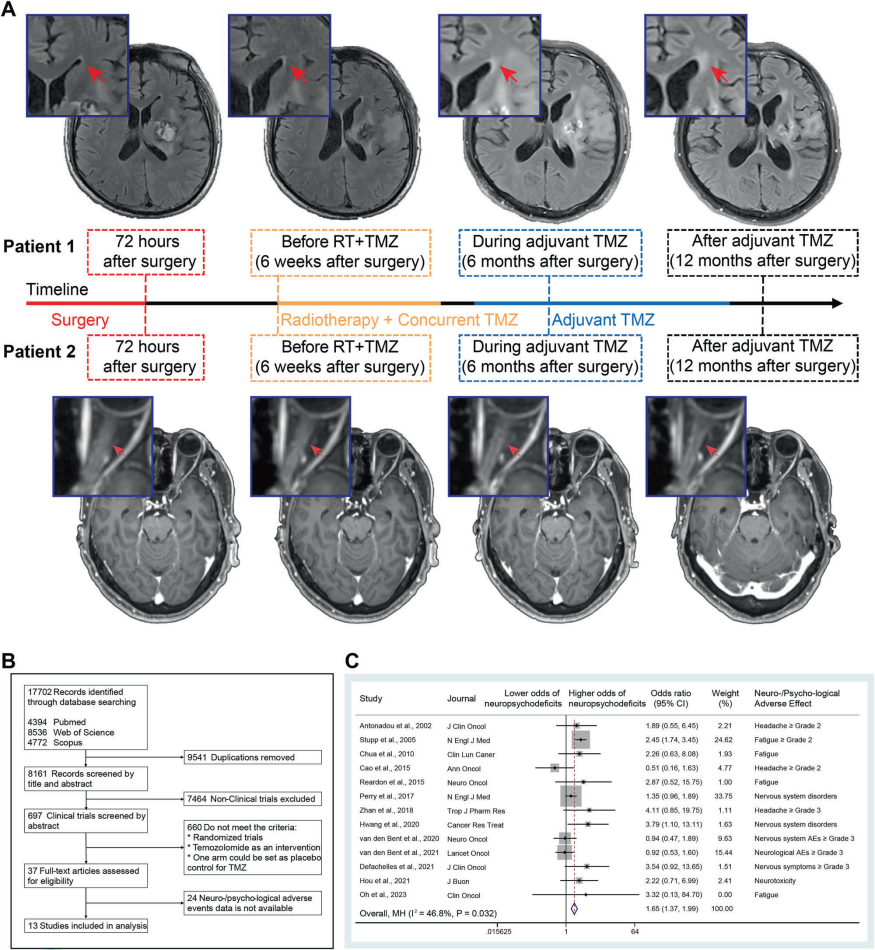
图1.化疗与中枢神经系统异常的临床关联
MRI影像显示,接受放疗联合化疗的胶质瘤患者在不同时间点出现白质异常信号。

02
研究方法
本研究采用“临床证据—动物模型—多组学分析—组织学与机制验证—药物干预评估”的整体研究策略。
在动物实验中,研究者分别构建了青少年期(3 周龄)与成年期(6 周龄)小鼠化疗给药模型,以模拟不同发育阶段中枢神经系统对化疗的反应差异。给药方案参考临床节律进行多周期腹腔注射;在成年模型中,进一步引入氯倍他索(CBT)连续给药,用于评估其对化疗诱导神经损伤的干预效果。
在机制研究层面,研究团队对小鼠皮层组织开展单核RNA测序(snRNA-seq),系统解析化疗药物处理后中枢神经系统细胞组成与状态变化;同时结合髓鞘染色、免疫荧光、Western blot、透射电镜(TEM)及行为学分析,从少突胶质细胞损伤、神经炎症反应及 AMPK 信号通路等多个层面进行验证。其中,免疫荧光图像由S3000 超快三维荧光成像系统采集完成。
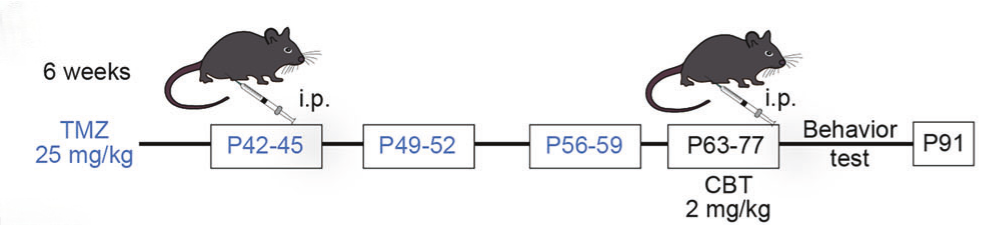
图2. 化疗处理及氯倍他索干预的整体实验流程示意图

03
研究结果
3.1 snRNA-seq揭示化疗诱导“多发性硬化样”细胞图谱改变
在青少年期小鼠模型中,snRNA-seq分析显示化疗药物处理后皮层细胞组成发生显著变化:成熟少突胶质细胞数量明显减少,髓鞘相关基因表达下调;与此同时,小胶质细胞向促炎表型偏移,神经炎症相关通路显著激活。这一细胞学特征与多发性硬化的核心病理改变高度相似。
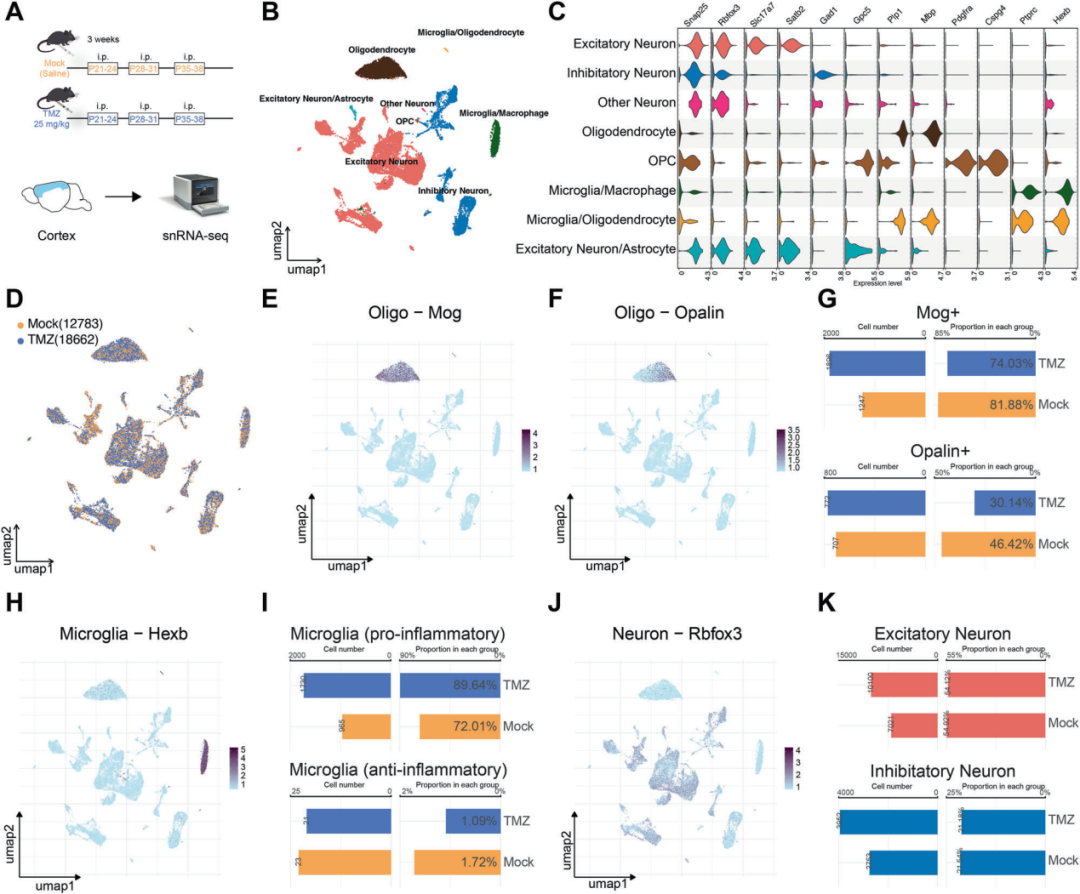
图3. 单核RNA测序揭示化疗诱导的中枢神经细胞组成变化
化疗药物处理后,成熟少突胶质细胞比例下降,小胶质细胞呈促炎表型转变,呈现多发性硬化样细胞特征。
3.2 组织学与免疫荧光证据证实脱髓鞘与神经炎症
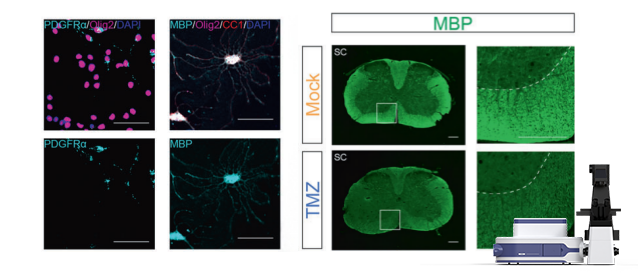
为在组织学层面验证化疗诱导的中枢神经损伤表型,研究团队进一步对小鼠脑组织与脊髓组织进行了系统的髓鞘染色与免疫荧光分析。结果显示,化疗药物处理后,胼胝体、皮层等区域MBP、MAG等髓鞘相关蛋白信号显著降低,提示少突胶质细胞成熟受损及髓鞘结构破坏。
与此同时,免疫荧光结果显示Iba1+小胶质细胞与GFAP+星形胶质细胞数量明显增加,提示化疗可诱发显著的神经炎症反应。这些结果从组织结构与细胞水平进一步证实了化疗药物在中枢神经系统中诱导的“多发性硬化样”病理改变。
上述多靶标免疫荧光图像均由S3000 超快三维荧光成像系统采集完成,为多区域神经组织中脱髓鞘与炎症反应的可视化与定量分析提供了稳定可靠的数据基础。得益于转盘共聚焦成像模式的高速采集优势,S3000能够高效完成多组织切片及多视野免疫荧光成像,满足本研究在多脑区、多样本条件下的成像需求。
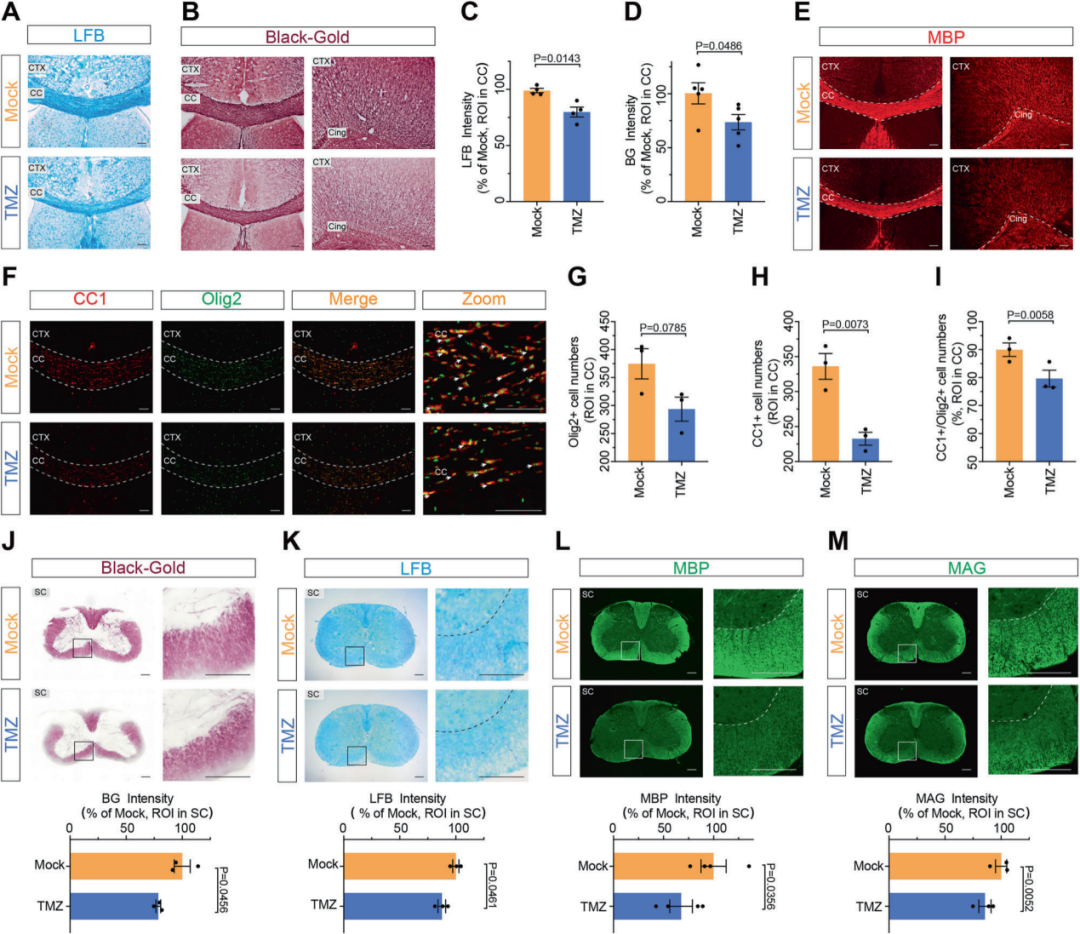
图4. 化疗药物诱导中枢神经系统脱髓鞘的免疫荧光等证据
MBP、MAG等髓鞘相关标记信号下降,少突胶质细胞成熟受损。
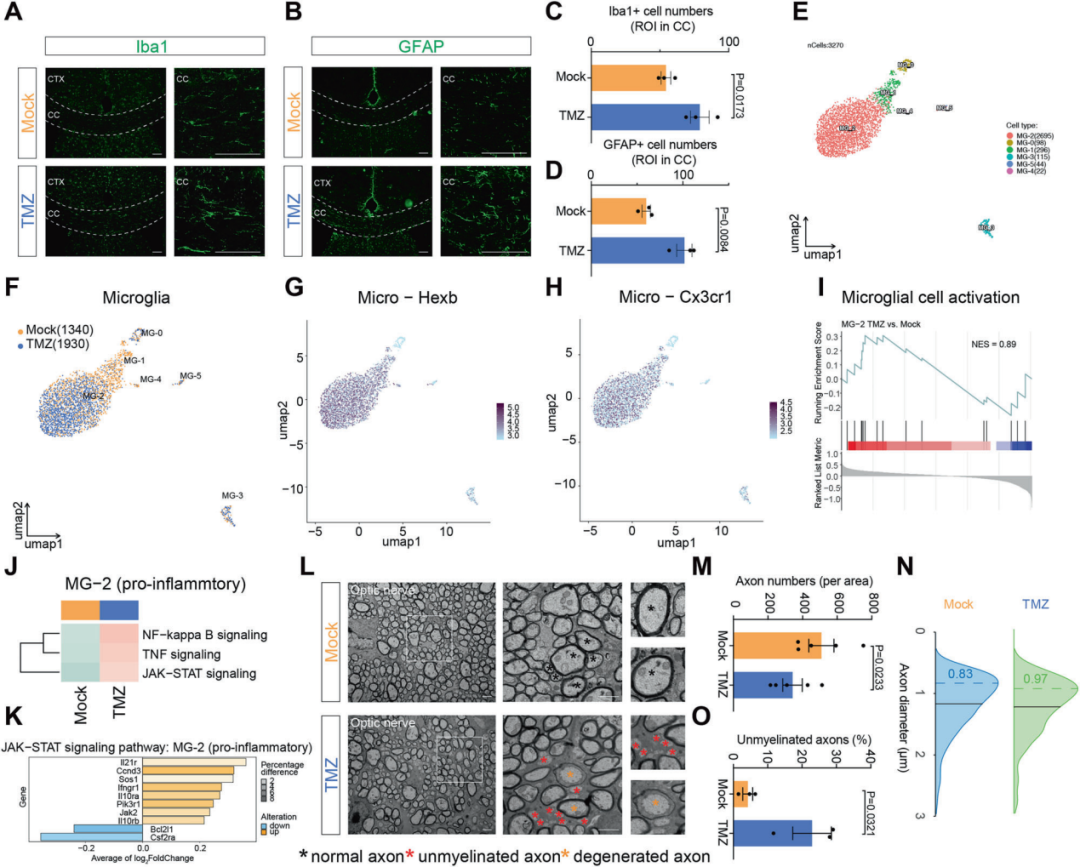
图5. 化疗诱导的神经炎症与轴突损伤
Iba1+小胶质细胞与GFAP+星形胶质细胞显著增加,并伴随轴突结构异常。
3.3 化疗激活AMPK信号通路并导致少突胶质细胞损伤
在明确化疗药物可诱导脱髓鞘与神经炎症表型后,研究进一步探究其分子机制。结果显示,化疗药物处理后少突胶质细胞中AMPK信号通路显著激活,并在皮层、脊髓及视神经等多个中枢区域呈现一致性变化。
在体外原代少突胶质细胞模型中,化疗药物可直接激活AMPK信号,并诱导少突胶质细胞损伤与死亡。为在细胞与组织层面直观验证该机制,研究团队对相关模型进行了免疫荧光分析,相关图像由S3000 超快三维荧光成像系统采集完成。
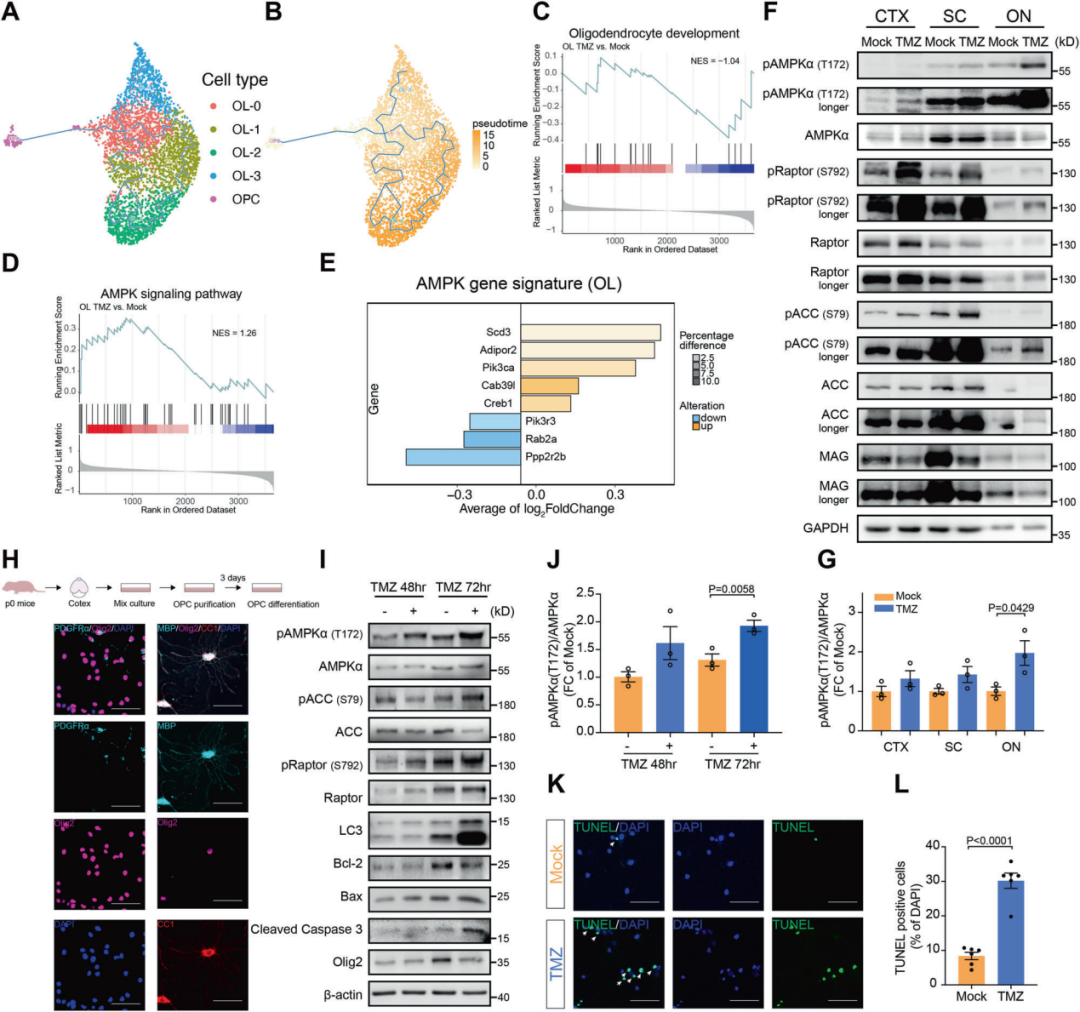
图6. 化疗激活AMPK信号并诱导少突胶质细胞损伤
转录组、蛋白检测及免疫荧光结果显示,化疗药物可激活少突胶质细胞AMPK信号通路并导致细胞损伤。
3.4 氯倍他索可逆转化疗药物诱导的中枢神经损伤
在成年小鼠模型中,化疗诱导的脱髓鞘与神经炎症损伤未见明显自发恢复;而氯倍他索干预可显著改善髓鞘完整性,减少未髓鞘化轴突比例,抑制神经炎症反应,并在一定程度上缓解焦虑/抑郁样行为趋势。
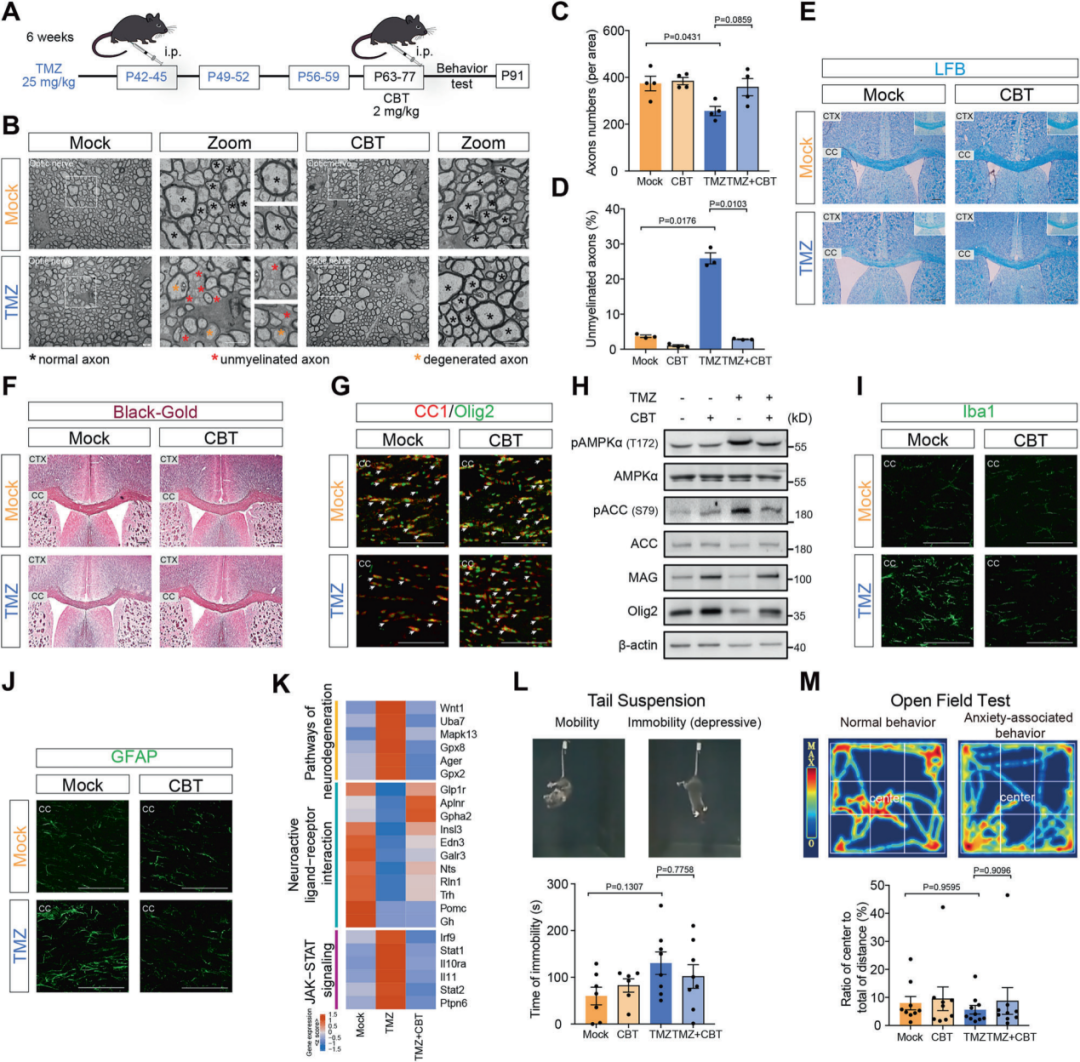
图7. 氯倍他索逆转化疗诱导的中枢神经病理改变
氯倍他索可改善脱髓鞘,减轻神经炎症,并抑制相关信号通路异常激活。

04
结论
本研究系统揭示了化疗在中枢神经系统中可诱发类似多发性硬化的病理改变,其机制与少突胶质细胞损伤、神经炎症增强及AMPK信号异常激活密切相关。研究进一步证明,氯倍他索可在成年模型中有效逆转上述神经损伤,为化疗相关神经毒性的干预提供了新的研究思路。

05
长光辰英价值
在本研究中,多发性硬化样中枢神经病理改变的验证高度依赖高质量、多靶标免疫荧光成像。研究团队采用S3000 超快三维荧光成像系统,完成了脑组织及少突胶质细胞模型中MBP、MAG、Olig2、CC1、Iba1、GFAP等多种关键标记的成像与定量分析,为研究结论提供了可靠的组织学证据。
S3000在本研究中发挥了重要技术支撑作用:一方面,其转盘共聚焦技术在保证成像清晰度与信噪比的同时,实现了高速免疫荧光采集,能够高效应对多区域、多样本的大规模成像需求;另一方面,稳定一致的成像性能为不同实验组之间的对比分析提供了良好的数据可重复性。
S3000 超快三维荧光成像系统为从“多组学发现”到“组织学与机制验证”的完整研究链条提供了坚实的成像保障。







